Tudo o que você precisa saber após os Temas 1234, 6 e as Súmulas Vinculantes 60 e 61

O Supremo Tribunal Federal redesenhou por completo o panorama da judicialização da saúde no Brasil.
Com o julgamento dos Temas 1234 e 6 da repercussão geral e a edição das Súmulas Vinculantes 60 e 61, em setembro e outubro de 2024, a Corte Suprema fixou balizas objetivas, rigorosas e vinculantes para o fornecimento judicial de medicamentos não incorporados ao Sistema Único de Saúde.
A partir de agora, advogados, magistrados, membros do Ministério Público e gestores públicos dispõem de um roteiro claro — e exigente — para lidar com essas demandas.
A relevância do tema é incontestável. O Brasil figura entre os países com maior volume de ações judiciais em saúde no mundo, e os gastos da União com o cumprimento dessas decisões superaram a marca de bilhões de reais nos últimos anos. Diante desse cenário, o STF promoveu uma verdadeira governança judicial colaborativa, reunindo União, Estados, Distrito Federal e Municípios em torno de três acordos interfederativos homologados no RE 1.366.243/SC.
Este texto tem finalidade didática. Vamos explorar, em linguagem acessível e com rigor técnico, cada aspecto dos novos marcos normativos — desde a competência da Justiça Federal até os requisitos para o deferimento excepcional de fármacos, passando pelos limites de cognição judicial e pela exigência de medicina baseada em evidências. Ao final, você encontrará a transcrição da questão discursiva do XV Concurso para Juiz Federal do TRF da 5ª Região (2025) e uma proposta fundamentada de resolução.
O que são, afinal, medicamentos não incorporados ao SUS
Antes de avançar sobre competência e requisitos, é indispensável compreender o que significa, juridicamente, um medicamento “não incorporado”. Essa definição, aliás, foi objeto de tratamento expresso pelo STF no item 2.1 do Tema 1234, o que eliminou boa parte das controvérsias que assolavam os tribunais.
De modo sintético, consideram-se medicamentos não incorporados aqueles que não constam na política pública do SUS — isto é, que não integram a RENAME (Relação Nacional de Medicamentos Essenciais), a RESME, a REMUME ou outras listas oficiais de dispensação. Porém, a definição vai além. Também se enquadram nessa categoria os fármacos previstos nos Protocolos Clínicos e Diretrizes Terapêuticas (PCDTs) para finalidades diversas daquela pretendida pelo paciente — o chamado uso off label sem respaldo protocolar.
De igual modo, os medicamentos sem registro na ANVISA e aqueles prescritos para uso off label sem que exista PCDT específico ou que não integrem as listas do componente básico são classificados como não incorporados. Perceba que o conceito é amplo e abrange situações bastante distintas entre si, cada qual com desdobramentos processuais e materiais próprios.
Essa classificação não é meramente acadêmica. Ela repercute diretamente na fixação de competência, no regime de custeio e nos requisitos para eventual deferimento judicial. Assim, o primeiro passo de qualquer análise — seja na petição inicial, seja na sentença — consiste em verificar se o fármaco pleiteado se enquadra ou não nessa definição.
Da STA 175 às Súmulas Vinculantes 60 e 61: a evolução dos marcos normativos
Para compreender o estágio atual da judicialização, é preciso revisitar brevemente a trajetória que nos trouxe até aqui. Afinal, por que o STF precisou intervir de forma tão incisiva nessa matéria?
O ponto de partida mais relevante remonta à Audiência Pública nº 4, convocada pelo então Presidente do STF, Ministro Gilmar Mendes, em abril de 2009. Durante seis dias, cinquenta especialistas debateram as complexidades do direito à saúde, da escassez de recursos e dos limites da intervenção judicial. Dessa audiência nasceu o julgamento da STA 175-AgR/CE, decidido pelo Plenário em 17 de março de 2010, que fixou cinco parâmetros basilares para orientar os magistrados.
A STA 175 estabeleceu, por exemplo, que o juiz deve verificar se a prestação pleiteada consta ou não das políticas do SUS; que o registro na ANVISA é condição imprescindível; que o Estado não pode ser compelido a fornecer tratamentos experimentais; e que deve ser privilegiado o tratamento oferecido pelo SUS, salvo comprovação de ineficácia no caso concreto. Esses critérios influenciaram decisivamente toda a jurisprudência nacional por mais de uma década.
Em paralelo, o arcabouço legislativo foi sendo aperfeiçoado. A Lei 12.401/2011 acrescentou os artigos 19-Q e 19-R à Lei 8.080/90, institucionalizando o papel da CONITEC e disciplinando o processo administrativo de incorporação de tecnologias.
O Decreto 7.646/2011 regulamentou minuciosamente esse processo. E a Recomendação CNJ nº 146/2023 estabeleceu estratégias para o cumprimento adequado das decisões judiciais em demandas de saúde pública, incluindo a consulta obrigatória ao NATJUS e a observância do PMVG.
Contudo, foi somente em setembro de 2024 que o STF conferiu caráter vinculante e definitivo a essas diretrizes, por meio do julgamento simultâneo dos Temas 1234 e 6, seguidos da edição das Súmulas Vinculantes 60 e 61.
A Súmula Vinculante 60 e os acordos interfederativos do Tema 1234
A Súmula Vinculante 60, aprovada pelo Tribunal Pleno em 16 de setembro de 2024 e publicada no DJE em 20 de setembro do mesmo ano, possui o seguinte enunciado:
"O pedido e a análise administrativos de fármacos na rede pública de saúde, a judicialização do caso, bem ainda seus desdobramentos (administrativos e jurisdicionais), devem observar os termos dos 3 (três) acordos interfederativos (e seus fluxos) homologados pelo Supremo Tribunal Federal, em governança judicial colaborativa, no tema 1.234 da sistemática da repercussão geral (RE 1.366.243)."O que isso significa na prática? Em termos objetivos, a SV 60 determina que todo o ciclo — desde o requerimento administrativo até a eventual execução da decisão judicial — deve seguir rigorosamente os fluxos estabelecidos nos três acordos interfederativos homologados pelo STF. Esses acordos tratam de seis diretrizes fundamentais: competência, definição de medicamentos não incorporados, custeio, análise judicial do ato administrativo, fluxo para medicamentos incorporados e criação de uma plataforma nacional de dispensação.
Portanto, não se trata de mera recomendação. A natureza vinculante da súmula impõe a observância obrigatória por todos os órgãos do Poder Judiciário e pela Administração Pública direta e indireta, nas esferas federal, estadual e municipal.
A Súmula Vinculante 61, por sua vez, foi aprovada em 20 de setembro de 2024 e publicada no DJE em 3 de outubro de 2024. Seu enunciado é direto:
“A concessão judicial de medicamento registrado na ANVISA, mas não incorporado às listas de dispensação do Sistema Único de Saúde, deve observar as teses firmadas no julgamento do Tema 6 da Repercussão Geral (RE 566.471).”
Em outras palavras, a SV 61 funciona como uma ponte normativa entre o precedente vinculante e a prática forense cotidiana. Ela confirma que nenhum magistrado pode deferir medicamento registrado na ANVISA, porém ausente das listas do SUS, sem observar integralmente os seis requisitos cumulativos fixados no Tema 6 — que examinaremos adiante.
A complementaridade entre as duas súmulas é evidente. Enquanto a SV 60 trata dos aspectos organizacionais e procedimentais (competência, fluxos, custeio), a SV 61 concentra-se nos requisitos materiais para a concessão excepcional do fármaco. Juntas, formam o arcabouço vinculante mais completo já produzido pelo STF em matéria de judicialização da saúde.
Competência da Justiça Federal segundo o Tema 1234
Como saber se determinada ação de medicamento deve tramitar na Justiça Federal ou na Justiça Estadual? Essa pergunta, que durante anos gerou insegurança jurídica e conflitos de competência, foi respondida de forma objetiva pelo Tema 1234 (RE 1.366.243/SC), de relatoria do Ministro Gilmar Mendes.
O critério dos 210 salários mínimos e o papel do PMVG
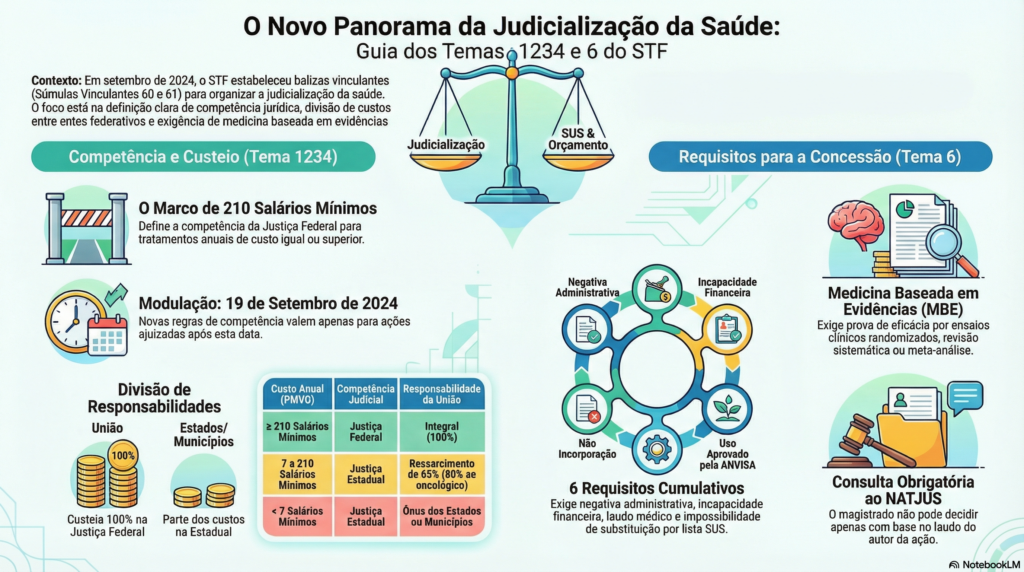
O critério eleito pelo STF é puramente objetivo e financeiro. As demandas relativas a medicamentos não incorporados na política pública do SUS, com registro na ANVISA, tramitarão perante a Justiça Federal quando o valor do tratamento anual específico do fármaco ou do princípio ativo — calculado com base no Preço Máximo de Venda ao Governo (PMVG), situado na alíquota zero de ICMS, divulgado pela Câmara de Regulação do Mercado de Medicamentos (CMED), nos termos da Lei 10.742/2003 — for igual ou superior a 210 salários mínimos.
Mas o que é, exatamente, o PMVG situado na alíquota zero? Trata-se do preço-teto para vendas à Administração Pública, calculado mediante aplicação do Coeficiente de Adequação de Preço (CAP) ao Preço Fábrica, sem incidência de ICMS. Esse parâmetro reflete o custo real do medicamento para o erário e é publicado periodicamente pela CMED. A opção pela alíquota zero garante uniformidade nacional, já que as alíquotas de ICMS variam entre os Estados.
Cabe destacar que o valor de referência é o do tratamento anual — e não o preço unitário da caixa ou do frasco. Essa distinção é fundamental, pois muitos medicamentos de alto custo possuem posologias que exigem múltiplas doses ao longo do ano, o que eleva significativamente o montante total.
Regras especiais para pluralidade de fármacos e ausência de valor na CMED
O Tema 1234 também tratou de situações específicas que surgem com frequência na prática forense. Quando existir mais de um medicamento do mesmo princípio ativo e o autor não solicitar um fármaco específico, deve-se considerar, para efeito de competência, aquele listado no menor valor na lista CMED (PMVG, alíquota zero). Essa regra evita que a escolha do medicamento mais caro — entre alternativas bioequivalentes — sirva como artifício para deslocar a competência.
E se o medicamento não constar da lista CMED? O STF previu essa hipótese. Nesse caso, o juiz deve solicitar à CMED a informação sobre o preço, com fundamento no artigo 7º da Lei 10.742/2003. Se a CMED não responder, admite-se excepcionalmente a utilização do orçamento apresentado pelo autor como parâmetro provisório de competência.
No caso de cumulação de pedidos, a tese é clara: para fins de competência, considera-se apenas o valor dos medicamentos não incorporados, que deverão ser somados entre si, independentemente da existência de cumulação alternativa de outros pedidos envolvendo obrigação de fazer, de pagar ou de entregar coisa certa. Essa regra impede a diluição artificial do valor para evitar a Justiça Federal.
A relação com o Tema 500 e os medicamentos sem registro ANVISA
Há, ainda, um ponto de interseção relevante. O Tema 500 (RE 657.718), julgado pelo STF em maio de 2019, trata especificamente de medicamentos sem registro na ANVISA. Naquele precedente, a Corte firmou que o Estado não pode ser obrigado a fornecer medicamentos experimentais e que a ausência de registro na ANVISA impede, como regra geral, o fornecimento judicial — salvo em caso de mora irrazoável da agência reguladora, quando preenchidos requisitos adicionais (existência de pedido de registro, registro em agências estrangeiras renomadas e inexistência de substituto terapêutico).
Pois bem. O Tema 1234 manteve expressamente a competência da Justiça Federal para essas ações, determinando que demandas por medicamentos sem registro na ANVISA devem ser propostas necessariamente em face da União. As duas teses se complementam harmonicamente: o Tema 500 cuida dos requisitos materiais para medicamentos sem registro, enquanto o Tema 1234 disciplina a competência e o custeio.
Modulação de efeitos: a data-parâmetro de 19 de setembro de 2024
Um aspecto de enorme importância prática diz respeito à modulação temporal dos efeitos da decisão. O STF determinou que as novas regras de competência somente se aplicam às ações ajuizadas após 19 de setembro de 2024 — data da publicação da ata do julgamento de mérito no DJE. Processos distribuídos antes dessa data permanecem na competência original, o que preserva a segurança jurídica e evita a redistribuição em massa de milhares de feitos.
No julgamento dos embargos de declaração, em 16 de dezembro de 2024 (publicados em 5 de fevereiro de 2025), o STF ratificou essa data-parâmetro e estendeu a modulação também aos medicamentos incorporados ao SUS, por razões de segurança jurídica. As disposições materiais relativas ao custeio e ao ressarcimento, contudo, aplicam-se a todos os processos, independentemente da data de ajuizamento.
O custeio dos medicamentos e a responsabilidade federativa
Quem paga a conta quando o Judiciário determina o fornecimento de um medicamento não incorporado? Essa questão, historicamente fonte de conflitos entre os entes federativos, recebeu tratamento minucioso no Tema 1234.
Nas demandas que tramitam na Justiça Federal — isto é, aquelas cujo tratamento anual atinge ou supera 210 salários mínimos —, o custeio é integralmente da União. Para medicamentos situados na faixa intermediária, entre 7 e 210 salários mínimos por ano, que tramitam na Justiça Estadual, a União ressarcirá 65% dos valores desembolsados, mediante repasses Fundo a Fundo (do Fundo Nacional de Saúde ao Fundo Estadual ou Municipal de Saúde). No caso de medicamentos oncológicos, esse percentual sobe para 80%. Medicamentos com custo anual de até 7 salários mínimos ficam a cargo do Estado ou do Município.
Ainda em matéria de custeio, o STF fixou um teto de preço: o valor de venda do medicamento, em cumprimento de decisão judicial, deve ser limitado ao menor valor entre o preço com desconto proposto no processo de incorporação na CONITEC (observado o reajuste pela CMED) e o valor já praticado pelo ente público em compra pública. Sob nenhuma hipótese poderá haver pagamento judicial superior ao teto do PMVG. Essa regra protege o erário contra sobrepreços e assegura racionalidade na aplicação dos recursos públicos.
Requisitos para o fornecimento judicial de medicamentos não incorporados: o Tema 6 em detalhes
Chegamos ao núcleo mais denso e exigente dos novos marcos: os requisitos para a concessão excepcional de medicamento não incorporado ao SUS. A tese firmada no Tema 6 (RE 566.471/RN), cuja redação final prevaleceu a partir do voto conjunto dos Ministros Luís Roberto Barroso e Gilmar Mendes, estabelece uma regra geral de vedação seguida de uma exceção condicionada ao preenchimento cumulativo de seis requisitos.
A regra geral: a ausência nas listas impede o fornecimento
O primeiro item da tese é categórico: a ausência de inclusão do medicamento nas listas de dispensação do SUS — RENAME, RESME, REMUME, entre outras — impede, como regra geral, o fornecimento do fármaco por decisão judicial, independentemente do custo.
Essa formulação é importante porque afasta a antiga concepção de que bastaria demonstrar a necessidade clínica para obter o medicamento em juízo. O STF reconheceu expressamente que as escolhas da Administração Pública em matéria de incorporação de tecnologias constituem políticas públicas legítimas, respaldadas em critérios técnicos, econômicos e epidemiológicos que merecem deferência judicial.
Os seis requisitos cumulativos da exceção
A concessão judicial somente é admissível quando preenchidos, simultaneamente, todos os requisitos a seguir, cujo ônus probatório incumbe ao autor da ação:
O primeiro requisito (alínea “a”) exige a negativa de fornecimento do medicamento na via administrativa, nos termos do item 4 do Tema 1234 da repercussão geral. Em outras palavras, o jurisdicionado deve demonstrar que buscou previamente o medicamento pela via administrativa e teve seu pedido expressamente indeferido ou ignorado. Essa exigência impõe o esgotamento — ou, ao menos, a tentativa — da via administrativa como condição de procedibilidade da ação judicial.
O segundo requisito (alínea “b”) é talvez o mais sofisticado. O autor deve demonstrar a ilegalidade do ato de não incorporação do medicamento pela CONITEC, ou a ausência de pedido de incorporação, ou ainda a mora na apreciação do pedido, tendo em vista os prazos e critérios previstos nos artigos 19-Q e 19-R da Lei 8.080/90 e no Decreto 7.646/2011. Vejamos cada hipótese.
A Lei 8.080/90, em seu artigo 19-R, prevê que o processo administrativo de incorporação deve ser concluído em prazo não superior a 180 dias, admitida prorrogação de 90 dias corridos.
O artigo 19-Q, por sua vez, exige que o relatório da CONITEC considere necessariamente as evidências científicas sobre eficácia, acurácia, efetividade e segurança do fármaco, além de avaliação econômica comparativa. Já o Decreto 7.646/2011 regulamenta detalhadamente as etapas do processo — desde a instauração até a consulta pública e a decisão final.
Portanto, se a CONITEC indeferiu a incorporação com base em critérios inadequados, sem observar o devido processo legal ou em desconformidade com a legislação de regência, haverá ilegalidade passível de controle judicial. Se ninguém jamais pediu a incorporação do fármaco, essa circunstância deverá ser demonstrada pelo autor. E se houve pedido, mas a CONITEC ultrapassou os prazos legais sem proferir decisão, configurar-se-á mora administrativa.
O terceiro requisito (alínea “c”) exige a demonstração de impossibilidade de substituição por outro medicamento constante das listas do SUS e dos PCDTs. Esse critério reforça a ideia de que o SUS possui um arsenal terapêutico amplo e que, antes de impor ao erário o custeio de fármaco não padronizado, o autor deve comprovar que as alternativas disponíveis não atendem à sua condição clínica.
O quarto requisito (alínea “d”) introduz uma exigência inédita na jurisprudência brasileira: a comprovação, à luz da medicina baseada em evidências, da eficácia, acurácia, efetividade e segurança do fármaco, necessariamente respaldada por evidências científicas de alto nível — ou seja, unicamente ensaios clínicos randomizados e revisão sistemática ou meta-análise. Adiante, dedicaremos um tópico específico a esse requisito.
O quinto requisito (alínea “e”) diz respeito à imprescindibilidade clínica do tratamento, que deve ser comprovada mediante laudo médico fundamentado, descrevendo inclusive qual o tratamento já realizado pelo paciente. Note-se que o laudo, embora necessário, não é suficiente por si só — ele deve ser corroborado pelas evidências científicas exigidas no requisito anterior.
Finalmente, o sexto requisito (alínea “f”) impõe a demonstração da incapacidade financeira do autor para arcar com o custeio do medicamento. Essa exigência acolhe a tese de que o direito à saúde, embora universal, não autoriza o Judiciário a financiar tratamentos para quem possui meios próprios de custeá-los, sob pena de comprometer a equidade do sistema.
Medicina baseada em evidências como exigência constitucional
Por que o STF exigiu, expressamente, que a comprovação de eficácia e segurança dos medicamentos seja respaldada unicamente por ensaios clínicos randomizados e revisão sistemática ou meta-análise? Essa escolha técnica não foi arbitrária — ela reflete o estado atual do conhecimento científico sobre a hierarquia de evidências.
Na chamada pirâmide de evidências, os relatos de caso e as opiniões de especialistas ocupam a base — são os níveis de menor confiabilidade. À medida que subimos, encontramos estudos observacionais (coorte, caso-controle), que oferecem maior robustez, mas ainda são suscetíveis a vieses. No topo da pirâmide estão os ensaios clínicos randomizados (ECR), considerados o padrão-ouro para avaliar a relação de causalidade entre intervenção e desfecho. E, acima de tudo, situam-se as revisões sistemáticas com meta-análise, que sintetizam estatisticamente os resultados de múltiplos ECRs, conferindo máximo poder e confiabilidade às conclusões.
A opção do STF por esse patamar elevado de exigência probatória tem três fundamentos claros. O primeiro é a proteção da saúde do próprio paciente: medicamentos respaldados apenas por evidências frágeis podem ser ineficazes ou até prejudiciais.
O segundo é a racionalidade na alocação de recursos escassos — o SUS atende mais de 200 milhões de brasileiros, e cada real gasto com um medicamento não comprovado é um real subtraído de políticas com eficácia demonstrada. O terceiro é o respeito à expertise técnica da CONITEC, que utiliza precisamente esses critérios em seus processos de incorporação.
Na prática, isso significa que um laudo médico isolado, por mais detalhado que seja, não basta para justificar o deferimento judicial.
O autor precisa juntar aos autos estudos científicos de alto nível que demonstrem a eficácia e a segurança do fármaco pretendido. Trata-se de uma exigência que, embora rigorosa, alinha o Judiciário às melhores práticas da ciência médica contemporânea.
As diretrizes impostas ao magistrado na análise judicial dos atos administrativos
Além de fixar os requisitos materiais para a concessão excepcional, o STF dedicou especial atenção aos limites da cognição judicial nas demandas de medicamentos. Essas diretrizes vinculam o magistrado sob pena de nulidade da decisão, nos termos dos artigos 489, §1º, incisos V e VI, e 927, inciso III, §1º, ambos do Código de Processo Civil.
Controle de legalidade sem incursão no mérito administrativo
O juiz, ao apreciar pedido de concessão de medicamento não incorporado, deve obrigatoriamente analisar o ato administrativo — comissivo ou omissivo — de não incorporação pela CONITEC ou de negativa de fornecimento na via administrativa. Essa análise, todavia, deve ser realizada à luz das circunstâncias do caso concreto e da legislação de regência, especialmente a política pública do SUS.
Há, porém, um limite claro e intransponível: não é possível a incursão no mérito do ato administrativo. O que isso quer dizer? Significa que o magistrado pode — e deve — verificar se o ato observou os requisitos formais, se respeitou o devido processo legal, se foi motivado adequadamente e se os motivos declarados correspondem à realidade dos fatos. Em uma palavra, o juiz exerce controle de legalidade. Não lhe é dado, contudo, substituir o administrador na avaliação técnica de mérito — isto é, não pode decidir se o medicamento deveria ou não ter sido incorporado ao SUS com base em sua própria convicção sobre a conveniência da política pública.
Essa diretriz guarda íntima relação com a teoria dos motivos determinantes, segundo a qual a validade do ato administrativo está condicionada à veracidade e à legalidade dos motivos que o fundamentaram. Assim, se a CONITEC indeferiu a incorporação sob determinado fundamento fático ou jurídico, o Judiciário pode verificar se esse fundamento é verdadeiro e juridicamente adequado. O que não pode é substituir o fundamento por outro de sua preferência ou reavaliar a relação custo-efetividade segundo critérios próprios.
A consulta obrigatória ao NATJUS e a vedação de fundamentação unilateral
Os Núcleos de Apoio Técnico do Poder Judiciário (NATJUS) são unidades compostas por profissionais da saúde — médicos, farmacêuticos, enfermeiros — vinculadas aos tribunais. Criados pela Resolução CNJ nº 238/2016 e fortalecidos pela Recomendação CNJ nº 146/2023, esses núcleos elaboram notas técnicas e pareceres científicos que auxiliam os magistrados na tomada de decisão.
Pois bem. O Tema 6, em seu item 3, alínea “b”, determina que o juiz deve aferir a presença dos requisitos de dispensação a partir da prévia consulta ao NATJUS, sempre que disponível na respectiva jurisdição, ou a entes ou pessoas com expertise técnica na área. A tese é incisiva ao prescrever que o magistrado não pode fundamentar sua decisão unicamente em prescrição, relatório ou laudo médico juntado aos autos pelo autor da ação.
Essa vedação tem razão de ser. O laudo médico do autor, embora relevante, expressa a perspectiva de um único profissional — que pode estar vinculado, consciente ou inconscientemente, a interesses do paciente ou até de laboratórios farmacêuticos. A consulta ao NATJUS introduz um contraditório técnico-científico, oferecendo ao juiz uma visão imparcial e baseada em evidências sobre a real necessidade, eficácia e disponibilidade de alternativas terapêuticas.
O dever de oficiar para incorporação ao SUS
A terceira diretriz — e talvez a mais inovadora — determina que, no caso de deferimento judicial do fármaco, o magistrado deve oficiar aos órgãos competentes para que avaliem a possibilidade de sua incorporação no âmbito do SUS.
Essa regra transforma o processo judicial em um mecanismo de retroalimentação da política pública: se um medicamento é judicialmente reconhecido como eficaz, seguro e imprescindível, é razoável que a Administração reconsidere sua não incorporação, beneficiando potencialmente toda a coletividade.
A pena de nulidade e os dispositivos do CPC
O artigo 489, §1º, do CPC estabelece que não se considera fundamentada a decisão judicial que se limita a invocar precedente ou súmula sem identificar seus fundamentos determinantes nem demonstrar que o caso se ajusta a eles (inciso V), ou que deixa de seguir precedente invocado pela parte sem demonstrar distinção ou superação (inciso VI). Já o artigo 927, inciso III, impõe a observância dos acórdãos em julgamento de recursos extraordinários repetitivos, e seu §1º remete às exigências de fundamentação do artigo 489.
A combinação desses dispositivos, expressamente citados na tese do Tema 6, significa que o juiz federal que conceder ou negar medicamento não incorporado sem analisar o ato administrativo, sem consultar o NATJUS ou sem demonstrar o enquadramento do caso nos precedentes vinculantes terá sua decisão eivada de nulidade absoluta. Não se trata de mera irregularidade formal, mas de vício que compromete a própria legitimidade constitucional da prestação jurisdicional.
A CONITEC e o processo de incorporação de tecnologias ao SUS
Entender o funcionamento da CONITEC é essencial para compreender por que o STF conferiu tanta deferência às suas decisões. A Comissão Nacional de Incorporação de Tecnologias no SUS, criada pela Lei 12.401/2011 e regulamentada pelo Decreto 7.646/2011, é um órgão colegiado permanente do Ministério da Saúde, composto atualmente por três comitês temáticos — Medicamentos; Produtos e Procedimentos; e Protocolos Clínicos e Diretrizes Terapêuticas — com 17 membros cada, representando secretarias do Ministério da Saúde, ANVISA, ANS, Conselhos de Saúde, CONASS, CONASEMS, CFM, AMB e sociedade civil.
O processo de incorporação, que pode ser deflagrado por qualquer interessado, percorre etapas rigorosas: análise de conformidade documental, avaliação técnica com base em evidências científicas, avaliação econômica comparativa e de impacto orçamentário, deliberação pelo comitê competente, consulta pública e decisão final. O prazo legal é de 180 dias, prorrogável por 90 dias corridos, com regime prioritário para tecnologias oncológicas, conforme a Lei 14.758/2023.
Quando o STF exige que o autor demonstre a ilegalidade do ato de não incorporação pela CONITEC, está, na verdade, reconhecendo que esse processo é técnico, participativo e juridicamente regulado — e que, em condições normais, suas conclusões merecem respeito. A intervenção judicial é a exceção, não a regra.
A Recomendação CNJ nº 146/2023 como instrumento de governança judicial
Editada em novembro de 2023 sob a relatoria do Conselheiro Richard Pae Kim e assinada pelo Ministro Luís Roberto Barroso, a Recomendação CNJ nº 146/2023 antecipou, em larga medida, as diretrizes que o STF viria a consolidar nos Temas 1234 e 6. Dentre seus dispositivos mais relevantes, destacam-se a recomendação de oitiva do NATJUS e do ente público demandado antes da concessão de tutelas; a priorização da tutela específica (fornecimento in natura) sobre o depósito de valores; a observância do PMVG com aplicação do CAP para liquidação de valores; e a fixação de prazos razoáveis para cumprimento — não inferiores a 120 dias para tecnologias importadas ou sem registro.
A Recomendação também desestimula o bloqueio imediato de contas públicas e a prisão de servidores, orienta a prestação periódica de contas pelo beneficiário e prevê a inclusão do paciente na rede SUS para verificação de alternativas terapêuticas. Embora não possua caráter vinculante por si só, a Recomendação 146 adquiriu nova relevância após a edição das Súmulas Vinculantes 60 e 61, servindo como diretriz interpretativa complementar aos precedentes do STF.
Como tudo se articula: um roteiro prático para o operador do direito
Diante de tantos marcos normativos, é útil sintetizar o caminho que o operador do direito deve percorrer ao deparar-se com uma demanda de medicamento não incorporado ao SUS.
O primeiro passo é verificar se o fármaco se enquadra na definição de “não incorporado” conforme o item 2.1 do Tema 1234.
Em seguida, apurar o valor do tratamento anual com base no PMVG (alíquota zero) da CMED para definir a competência — Justiça Federal se igual ou superior a 210 salários mínimos. Caso o medicamento não conste da lista CMED, oficiar à Câmara para obtenção do valor ou, subsidiariamente, utilizar o orçamento do autor.
Na sequência, o autor deverá demonstrar o preenchimento cumulativo dos seis requisitos do Tema 6: negativa administrativa prévia, ilegalidade ou omissão da CONITEC, impossibilidade de substituição, comprovação por MBE com evidências de alto nível, imprescindibilidade clínica com laudo fundamentado e incapacidade financeira. O juiz, por sua vez, deve consultar o NATJUS, analisar o ato administrativo nos limites da legalidade e, se deferir, oficiar para eventual incorporação.
Esse roteiro, longe de ser um mero checklist burocrático, reflete uma mudança de paradigma: a judicialização da saúde deixa de ser um campo aberto à discricionariedade judicial e passa a ser regida por critérios objetivos, vinculantes e cientificamente respaldados.
Transcrição integral da questão discursiva — XV Concurso para Juiz Federal do TRF da 5ª Região (2025)
A questão abaixo foi aplicada pela Fundação Getúlio Vargas na prova discursiva do concurso de magistratura federal do TRF5, realizada em 27 de julho de 2025, valendo 4 pontos e com limite de 120 linhas:
“À luz do que foi decidido pelo Supremo Tribunal Federal nos Temas 1234 e 6 da sistemática da repercussão geral, bem como das Súmulas Vinculantes 60 e 61, discorra sobre a atuação do Poder Judiciário nas ações judiciais que visam ao fornecimento de medicamentos não incorporados às listas oficiais do Sistema Único de Saúde (SUS). Em sua resposta:
a) analise a competência da Justiça Federal nas ações que envolvam medicamentos não incorporados ao SUS, especialmente quanto aos critérios objetivos e à modulação de efeitos definida pelo STF no Tema 1234.
b) indique os requisitos legais e jurisprudenciais a serem preenchidos para que se admita judicialmente o fornecimento de medicamento não incorporado, segundo o entendimento do STF no Tema 6.
c) apresente as diretrizes impostas ao magistrado no exame da legalidade dos atos administrativos de indeferimento de fornecimento de medicamentos não incorporados, incluindo os limites de cognição judicial e as exigências probatórias a serem observadas.”
Proposta de resolução da questão discursiva
O Supremo Tribunal Federal, ao julgar os Temas 1234 e 6 da repercussão geral e editar as Súmulas Vinculantes 60 e 61, estabeleceu um regime jurídico completo e vinculante para a atuação do Poder Judiciário nas demandas que versam sobre medicamentos não incorporados às listas oficiais do SUS.
a) Competência da Justiça Federal (Tema 1234 — RE 1.366.243/SC)
A competência da Justiça Federal, nos termos do art. 109, I, da Constituição Federal, foi fixada com base em critério objetivo e financeiro. As ações relativas a medicamentos não incorporados ao SUS, com registro na ANVISA, tramitarão perante a Justiça Federal quando o valor do tratamento anual específico do fármaco, calculado com base no Preço Máximo de Venda ao Governo (PMVG), situado na alíquota zero de ICMS, divulgado pela CMED (Lei 10.742/2003), for igual ou superior a 210 salários mínimos.
Consideram-se medicamentos não incorporados aqueles ausentes da política pública do SUS, os previstos nos PCDTs para finalidades diversas da pretendida, os sem registro na ANVISA, os de uso off label sem PCDT e os que não integram listas do componente básico. Em havendo mais de um fármaco do mesmo princípio ativo, adota-se o de menor valor na CMED para fins de competência. Na ausência de preço na lista CMED, o juiz deve oficiar à Câmara nos termos do art. 7º da Lei 10.742/2003, admitindo-se subsidiariamente o orçamento do autor. Na cumulação de pedidos, somam-se apenas os medicamentos não incorporados.
Para medicamentos sem registro na ANVISA, mantém-se a competência da Justiça Federal, devendo a ação ser proposta necessariamente em face da União, conforme o Tema 500 (RE 657.718). Na Justiça Federal, o custeio é integralmente da União.
Quanto à modulação de efeitos, as novas regras de competência aplicam-se exclusivamente às ações ajuizadas após 19 de setembro de 2024, data da publicação da ata do julgamento de mérito, conforme ratificado nos embargos de declaração. As disposições materiais relativas ao custeio aplicam-se a todos os processos, independentemente da data de ajuizamento.
b) Requisitos para fornecimento judicial (Tema 6 — RE 566.471/RN)
A Súmula Vinculante 61 impõe a observância das teses firmadas no Tema 6. A regra geral é objetiva: a ausência de inclusão do medicamento nas listas de dispensação do SUS (RENAME, RESME, REMUME, entre outras) impede o fornecimento por decisão judicial, independentemente do custo.
Excepcionalmente, admite-se a concessão judicial de medicamento registrado na ANVISA, mas não incorporado, desde que preenchidos cumulativamente seis requisitos, cujo ônus probatório incumbe ao autor. São eles: negativa de fornecimento na via administrativa, nos termos do item 4 do Tema 1234; demonstração de ilegalidade do ato de não incorporação pela CONITEC, ausência de pedido de incorporação ou mora na apreciação, à luz dos arts. 19-Q e 19-R da Lei 8.080/90 e do Decreto 7.646/2011; impossibilidade de substituição por medicamento das listas do SUS e dos PCDTs; comprovação, à luz da medicina baseada em evidências, da eficácia, acurácia, efetividade e segurança do fármaco, respaldada unicamente por ensaios clínicos randomizados e revisão sistemática ou meta-análise; imprescindibilidade clínica do tratamento, mediante laudo médico fundamentado com descrição do tratamento já realizado; e incapacidade financeira para arcar com o custeio.
A exigência de evidências de alto nível impede que o Judiciário determine o fornecimento de medicamentos com base apenas em prescrições individuais ou estudos de baixo nível científico, resguardando o erário e a saúde pública.
c) Diretrizes para o magistrado e limites de cognição judicial (Temas 1234 e 6)
Sob pena de nulidade da decisão judicial — nos termos do art. 489, §1º, incisos V e VI, combinado com o art. 927, inciso III, §1º, do CPC —, o magistrado deve obrigatoriamente observar três diretrizes ao apreciar pedidos de medicamentos não incorporados.
Em primeiro lugar, cumpre ao juiz analisar o ato administrativo comissivo ou omissivo de não incorporação pela CONITEC ou de negativa da via administrativa, à luz das circunstâncias do caso concreto e da legislação de regência. Essa análise, contudo, restringe-se ao exame de legalidade e regularidade procedimental, na linha da teoria dos motivos determinantes. O juiz verifica a veracidade e a adequação jurídica dos motivos que fundamentaram o ato, mas não pode substituir o administrador na avaliação de mérito — isto é, não lhe é dado realizar incursão no mérito administrativo nem reavaliar a conveniência e oportunidade da política pública.
Em segundo lugar, o magistrado deve aferir os requisitos de dispensação a partir da prévia consulta ao Núcleo de Apoio Técnico do Poder Judiciário (NATJUS), sempre que disponível na jurisdição, ou a entes e pessoas com expertise técnica. A decisão não pode ser fundamentada unicamente em prescrição, relatório ou laudo médico juntado pelo autor, exigindo-se o contraditório técnico-científico proporcionado pela nota técnica do NATJUS.
Por fim, em caso de deferimento judicial do fármaco, o juiz deve oficiar aos órgãos competentes para que avaliem a possibilidade de incorporação do medicamento ao SUS, convertendo o processo judicial em instrumento de retroalimentação da política pública de saúde.
Essas diretrizes, conjugadas com as Súmulas Vinculantes 60 e 61, representam verdadeira mudança de paradigma: a judicialização da saúde passa a ser regida por critérios objetivos, vinculantes e cientificamente respaldados, conciliando o direito fundamental à saúde com a racionalidade na gestão dos recursos públicos do SUS.
Conclusão
O julgamento dos Temas 1234 e 6 pelo STF, acompanhado da edição das Súmulas Vinculantes 60 e 61, representa o mais significativo avanço normativo na judicialização da saúde brasileira desde a Audiência Pública nº 4, realizada em 2009. A Corte não apenas definiu critérios objetivos de competência e custeio — como o patamar de 210 salários mínimos aferido pelo PMVG —, mas também elevou o patamar probatório ao exigir evidências científicas de alto nível, alinhando o Judiciário à medicina baseada em evidências.
A vedação de incursão no mérito administrativo, a obrigatoriedade de consulta ao NATJUS e o dever de oficiar para incorporação revelam um Judiciário que reconhece seus próprios limites institucionais e busca dialogar com a Administração Pública, em vez de substituí-la. A pena de nulidade prevista nos artigos 489, §1º, e 927, III, §1º, do CPC funciona como mecanismo de enforcement, assegurando que essas diretrizes sejam efetivamente observadas.
O desafio agora é de implementação. A expansão dos NATJUS a todas as jurisdições, a consolidação da plataforma nacional de dispensação e a adaptação dos operadores do direito a esse novo paradigma são tarefas inadiáveis. O que não se pode admitir é o retorno ao cenário anterior, em que decisões isoladas, baseadas exclusivamente em laudos médicos da parte autora e desconectadas das políticas públicas de saúde, comprometiam a equidade e a sustentabilidade do SUS.

Crimes contra a honra no condomínio - questão comentada

Na doação, o bem pode voltar ao doador? entenda a cláusula de reversão

Teorias interna e externa dos direitos fundamentais
Controle de constitucionalidade em face de Constituição revogada? (MP/PR 2017)
Hey,
o que você achou deste conteúdo? Conte nos comentários.

